En las últimas décadas ha crecido el estudio los mecanismos involucrados en el comportamiento social, gran parte de estas indagaciones se han realizado desde una aproximación de la neurociencia social cognitiva, la cual se basa en un modelo representacional del procesamiento de información. No obstante, esta aproximación ha sido ampliamente criticada por desconocer la participación del cuerpo, la dinámica afectiva, el contexto social, el cambio durante el desarrollo y suponer un procesamiento modular endógeno. En este sentido, este artículo presenta un modelo neurodinámico de la cognición social (CS), comprendiéndola desde una aproximación enactiva, situada, relacional y sistémica. Desde este modelo se describen los principales cambios en esperados la actividad cerebral durante las interacciones sociales en tiempo real y durante la ontogenia. Se concluye resaltando los desafíos y oportunidades que este tipo de aproximaciones puede proporcionar a la neurociencia y psicología social del futuro.
El propósito de este escrito es proponer un modelo de la cognición social basado en una postura dinámica, enactiva y del desarrollo, con este modelo se tratará de dar sentido a los hallazgos que se han hecho en las últimas décadas desde la neurociencia social. La CS puede concebirse como una variedad de procesos psicológicos y biológicos que permiten detectar y atribuir sentido intencional y afectivo a las señales provenientes de otros (Eisenberg, 2013; León, 2013; Rushworth, Mars, & Sallet, 2013), estos procesos incluyen fenómenos como la percepción de señales corporales, el conocimiento implícito y explícito sobre los estados mentales propios y ajenos, la formación y mantenimiento de vínculos afectivos, la formación de actitudes, la moralidad, entre otros (Frith & Frith, 2012; Grande-García, 2009). Desde finales del siglo XX las neurociencias se han enfocado en comprender los mecanismos neurobiológicos asociados a estos procesos (Adolphs, 2001; Cacioppo & Bernston, 2002; Harmon-Jones & Winkielman, 2007; Pelphrey, Adolphs, & Morris, 2004), en especial, mediante el uso de imágenes cerebrales (Fiske & Tailor, 2008; Lieberman, 2007a, 2007b).
Los principales modelos teóricos sobre la CS (Adolph, 1999 y 2001; Heberlein y Adolph, 2005) se fundamentan a una postura informacional que asume la CS como un grupo de procesos cómputo de representaciones sobre los demás (Beer & Ochsner, 2006; Wiltshire et al., 2015). En estas aproximaciones la CS suele explicarse desde modelos lineales, donde el procesamiento social es llevado a cabo por módulos cerebrales innatos que han sido seleccionados ancestralmente, los cuales computan y representan la información social (Adolph, 2003; Lieberman, 2006, 2010). Al conjunto de estos módulos, se les llegó a conocer como cerebro social (Adolph, 2009; Isel & Fernand, 2004; Frith & Frith, 2012). Estas posturas han sido criticadas por sobre-simplificar la complejidad de la CS, del funcionamiento encefálico y del desarrollo humano, ya que suelen subestimar la importancia del contexto, la dependencia temporal y el carácter relacional.
En la última década han tomado fuerza las aproximaciones interaccionistas apoyadas en teorías de la cognición enactiva, corporizada, ecológica y en los sistemas dinámicos (Wiltshire et al., 2015). Desde la enacción la CS es a la vez percepción y acción en un cuerpo vivo situado, donde los procesos nerviosos se arraigan en un cuerpo incrustado en un mundo de interacciones sociales (De Jaegher & Di Paolo, 2007; De Jaegher, Di Paolo & Gallagher, 2010; Goldman & de Vignemont, 2009). En este sentido, tanto destrezas sociales como circuitos neurales se forman mutuamente en un proceso de co-desarrollo, el cual ocurre a través de acoplamientos a múltiples niveles espaciotemporales (Di Paolo & De Jaegher, 2012). La teoría de sistemas dinámicos complejos permite comprender cómo estos sistemas van cambiando su comportamiento a través del tiempo, un sistema dinámico tiene tres características principales: 1) está compuesto por una gran cantidad de componentes que interactúan entre sí de forma compleja (no-linear), es decir, el comportamiento del sistema no puede ser predicho desde la suma de los comportamientos individuales de sus componentes; 2) hay emergencia en las propiedades del sistema; y 3) el comportamiento emergente es auto-organizado, ya que no depende únicamente de las condiciones internas o externas, sino que es el resultado de acoplamientos complejos entre diferentes niveles de organización en un proceso de causalidad circular (Richardson, Dale, & Marsh, 2014).
A continuación, se fundamentará empírica y teóricamente un nuevo modelo para comprender la CS, el cual toma como eje articulador las propuestas de los sistemas dinámicos, la enacción, y el desarrollo ontogenético. Con este modelo se busca explicar la emergencia de algunas habilidades sociales, la emergencia de estas habilidades durante la ontogenia depende de la organización de ciertos sistemas socio-afectivos, los cuales están estrechamente relacionados al desarrollo de ensamblajes neurales, patrones de actividad encefálica y cambios en las relaciones sociales (Barrett & Satpute, 2013). En el modelo, se contemplan cuatro categorías, las cuales permiten agrupar los sistemas socio-afectivos y dar sentido al cambio que sucede durante las interacciones sociales y la ontogenia (Tabla 1). A partir de este punto se van a describir cada una de las categorías intentando clarificar los componentes neurodinámicos que las caracterizan.
Esta categoría agrupa dos sistemas, el primero se compone de los procesos implicados en construcción de imágenes perceptuales a partir de las señales sociales y el segundo hace alusión a los de mecanismos que permiten la resonancia oscilatoria entre las señales sociales percibidas y los despliegues sociales ejecutados.
Dadas las limitaciones de espacio, el escrito se limitará al sistema visual como un ejemplo de la organización neurofuncional del mapeo somático de los estímulos sociales, no obstante, en algunas especies sociales son más relevantes los mapas auditivos, olfativos y táctiles. En primates el sistema visual es el principal dispositivo de mapeo de señales sociales y está compuesto por una variedad de regiones corticales y subcorticales involucradas en crear imágenes significativas sobre los demás.
Percepción de rostros: la percepción de los rostros permite la identificación de las personas en términos de raza, género y cercanía social, además, facilita la detección de señales afectivas y disposiciones mentales ajenas (Haxby & Gobbini, 2011), lo cual se convierte en una habilidad importante para la supervivencia (Bachevalier & Meunier, 2005). La percepción facial implica dos capacidades: la identificación del rostro y el reconocimiento de las expresiones faciales (Calder & Young, 2005), Haxby y Gobbini (2011) proponen un sistema central para el análisis visual de las caras, el cual estaría compuesto por células del área occipital para caras (OFA 2 ), el área fusiforme para caras (FFA 3) y el surco temporal superior posterior (STSp) (Figura 1). Este circuito se ha reportado en estudios de registro intracraneal en primates no humanos (Adolph, 2001), en pacientes con lesiones cerebrales y a través de imágenes funcionales del cerebro (Lieberman, 2010; Olivares & Iglesias, 2000). La identificación de rostros se basaría en un sistema encargado de analizar rasgos invariantes, el cual depende de la actividad de OFA y FFA, mientras que el reconocimiento de expresiones estaría soportado por un sistema que codifica cambios en la configuración facial, vinculado con la actividad en el STSp (Haxby & Gobbini, 2011). No obstante, Rhodes y colaboradores (2015) han insistido en que el procesamiento de la identidad y la expresión harían parte de un único sistema general con importantes variaciones individuales en el análisis de rasgos específicos, lo cual explicaría los cambios y la especialización en el reconocimiento facial a través del desarrollo (Wiese et al., 2013).
Además de los circuitos nucleares, se ha propuesto la participación de áreas límbicas y frontoparietales, no obstante, el reclutamiento de estas áreas depende en buena medida de la tarea empleada y podría reflejar la participación de sistemas afectivos, de atribución mental y ejecutivos (Haxby & Gobbini, 2011; Todorov et al., 2013). Existen evidencias que indican que la neurodinámica del procesamiento facial ocurre en tres momentos: 1) una actividad positiva occipital temprana, aproximadamente a los 120 ms (P120), asociada con la detección visual del rostro; 2) una depleción negativa, cerca de los 170 ms (N170), proveniente de la corteza occipito-temporal, relacionada con la discriminación de los rostros desde otros objetos y su percepción como una Gestalt; 3) una actividad tardía vinculada con la identificación de los rostros y la asignación de un significado mnémico y afectivo (N250r y N400) (Olivares et al., 2012; Righi & Nelson, 2012).
La capacidad de identificar rostros se desarrolla durante los primeros meses postnatales, incluso neonatos prefieren mirar objetos similares a caras (Johnson, 2005), rasgo posiblemente relacionado con procesos mesencefálicos. Durante el primer año ocurre una especialización cortical gradual, de tal forma que hacia los dos meses hay actividad metabólica en una red difusa comprendida por el giro temporal superior e inferior, regiones occipitales, parietales y frontales inferiores, lo que permite a los infantes discriminar rostros por su familiaridad, género y raza (Righi & Nelson, 2012). Progresivamente la red se va restringiendo para proporcionar un procesamiento más preciso, que coincide con la actividad eléctrica más estable occipital y temporal (N290) (Grossmann & Johnson, 2007).
La prosopoagnosia es la principal alteración en la percepción de rostros, se puede presentar de forma adquirida o por un desorden del neurodesarrollo, en la variante adquirida existe una seria limitación en el reconocimiento de rostros familiares (Righi & Nelson, 2012; Susilo & Duchaine, 2013). En niños con prosopoagnosia adquirida, los problemas incluyen limitaciones en la percepción facial y no-facial, que suelen estar asociadas a desordenes en la migración celular debidos a variaciones alélicas autosómicas dominantes (Susilo & Duchaine, 2013).
Seguimiento de la mirada: este es un acto automático e incontenible esencial para la comunicación, que proporciona información sobre lo que los demás están atendiendo y desean hacer (Baron-Cohen, 1995), las personas que fallan en seguir la mirada son evaluados como poco fiables y deshonestos (Frith & Frith, 2012). Otros animales como cuervos, pollos, perros, simios y ciertos reptiles pueden reconocer cuando se les mira de forma directa al detectar los pequeños cambios en los componentes de los ojos (Stone, 2007; Zuberbuhler, 2008). La mirada es procesada por una red cerebral distribuida que se traslapa con la de la percepción facial y del movimiento (Figura 1) (STS, FFA y área temporal medial) (Johnson & Farroni, 2003; Nummenmaa & compañeros, 2008). Carlin y Calder (2013) resaltan la participación del STPa, la corteza parietal lateral y la corteza prefrontal medial (CPFM), donde la STPa llevaría a cabo el análisis perceptual para determinar qué tipo de objetos está mirando una persona y la STSp estará más asociado con la percepción del movimiento biológico y la asignación de intencionalidad (Hein & Knight, 2008; Stone, 2007).
Esta habilidad se desarrolla de forma muy temprana, neonatos son sensibles al contacto visual con miradas directas o desviadas y muestran preferencia por caras con ojos abiertos. Alrededor de los 4 meses ya son capaces de seguir los cambios en la dirección de las miradas y guiar su atención basados en la mirada ajena. Durante el segundo año adquieren la habilidad de monitorear activamente las miradas, es decir, que las pueden usar como fuente de información para guiar su aprendizaje e interacción social (Grossmann & Johnson, 2007). El sistema de seguimiento de miradas rápidamente se integra a un sistema de resonancia motora, lo cual permite ir construyendo un conocimiento implícito de las secuencias de acciones apropiadas para los contextos sociales (León, 2013). Durante el desarrollo debe ocurrir una especialización del STS, en adultos ésta estructura presenta una amplia actividad eléctrica y metabólica ante la presentación de miradas, no obstante, en infantes la actividad eléctrica parece provenir en conjunto del STS y FFA. En bebés se han observado cambios en la amplitud del potencial eléctrico N290 tanto para dirección de la mirada como la posición de la cara, mientras que en adultos este patrón se mantiene solo para la posición de la cara, esto ha llevado a pensar que la percepción facial y la mirada comparten un sistema común durante la infancia temprana, el cual se especializa en el procesamiento de caras durante la niñez intermedia (Grossmann & Johnson, 2007).
Alteraciones en el procesamiento de la mirada han sido reportadas en el trastorno del espectro autista (TEA) (Davies et al., 2011; Senju & Johnson, 2008), trastorno de ansiedad social (Schulzeetal., 2013) y esquizofrenia (Hooker & Park, 2005). Davies y colaboradores (2011) reportaron que niños TEA muestran una actividad metabólica diferente en la corteza prefrontal ventromedial (CPFvm) para miradas desviadas y directas, Auyeung y compañeros (2015) analizan la conectividad aberrante en las personas con TEA quienes presentan menor especialización hemisférica y reducida coherencia fronto-temporo-pariental la cual puede estar asociada a alteraciones en la comunicación oxitoninérgica.
Percepción del movimiento biológico: los humanos tienen una especial habilidad para discriminar objetos vivos que se mueven, en especial se parecen cuerpos humanos, (Johansson, 1973), esta habilidad se desarrolla durante el primer semestre postnatal, niños de cuatro meses muestran más preferencia por figuras humanas de puntos luminosos sin inversiones (Kuhlmeier et al. 2010, Voos et al., 2012), lo que activa una red frontotemporal (Lloyd-Fox et al., 2011), con una actividad eléctrica cerebral específica (Voos et al., 2012) y lateralizada hacia el hemisferio derecho (Grossmann & Johnson, 2007). En adultos, parecen haber dos rutas de procesamiento: una ventral y otra dorsal (Vaina et al, 2001). La ruta ventral estaría encargada del reconocimiento de objetos socialmente significativos como las caras y los cuerpos. La ruta dorsal estaría compuesta por una red que implica la corteza intraparietal y el área temporal medial, las cuales estarían involucradas con la percepción del movimiento no-biológico, estas rutas se proyectan convergentemente sobre el STSp, la cual es esencial para el reconocimiento del movimiento biológico (Grossman et al., 2000). El STSp también está involucrado en el seguimiento de los ojos, la boca y las manos, la interpretación de la mirada y la inferencia de intenciones ajenas, por ello, para Heberlein y Adolph (2005) el STSp haría parte de un sistema de atribución automática de intenciones.
La estrecha relación temporal entre la actividad de los sistemas perceptuales y los sistemas neuromotores permite un rápido acoplamiento entre los sujetos que participan en las interacciones, el cual es fundamental para el desarrollo social y el aprendizaje vicario, ya permite la incorporación de acciones socialmente relevantes. La capacidad de imitar acciones ajenas ha sido definida como “reflexión”4 o 4 resonancia social (Frith y Frith, 2012), el concepto de resonancia enfatiza la enacción y corporización durante la interacción social,ya que sucede una participación sincrónica entre agentes que componen un sistema social complejo. En este proceso parece tener especial relevancia el sistema de neuronas espejo (SNE) (Gallese et al., 1996; Ramachandran, 2010;Rizzolatti y Arbib, 1998). El SNE se ha concebido como el sustrato de la simulación, que para algunos es la base de la comprensión de los estados mentales ajenos (Iacoboni, 2009; Oberman y Ramachandran, 2006) y sería el mecanismo neural que permite la convergencia entre percepción social, preparación motora y sincronización espontánea entre individuos (Iacoboni & Dapretto, 2006).
El SNE es un conjunto de células nerviosas ubicadas en la corteza premotora (Rizzolatti y Craighero, 2004) y parietal (Iacoboni, 2005; Iacoboni, 2009) de los simios, que presentan actividad eléctrica robusta ante la ejecución de una acción compleja o ante la percepción de acciones con objetivos similares (Fogassi & Gallese, 2002). La respuesta eléctrica de estas células parece mantenerse aun cuando solo se brindan claves contextuales, lo que ha llevado a plantear que el SNE permite abstraer los objetivos de las acciones aprendidas (Iacoboni & Dapretto, 2006; Umiltà Carlo, 2007). Dentro de los pocos estudios que han encontrado actividad eléctrica en espejo está el de Mukamel y compañeros (2010) quienes registraron una respuesta eléctrica similar en neuronas del área motora suplementaria y del lóbulo temporal medial ante la observación y ejecución de sonrisas y movimientos manuales. La mayor parte de las evidencias sobre un SNE humano son indirectas (Cook et al., 2014), de ellas se ha inferido que pueden existir diferentes sistemas que se comportan como resonadores neuromotores. Las principales zonas que harían parte del SNE somático son: la corteza premotora (PMC), las áreas parietales inferiores (Fadiga etal., 2002; Möhring et al., 2014; Rizzolatti y Craighero, 2004), la corteza motora suplementaria (SMA), la corteza motora primaria, corteza somatosensorial primaria y secundaria, y el cerebelo (Destro & Rizzolatti, 2008) (Figura 1). Áreas como la ínsula anterior, la corteza cingulada anterior, la amígdala y el área parahipocampal también han recibido el trato de SNE, pero estarían más acopladas a los sistemas afectivos y a la capacidad de resonancia del sistema motor neurovegetativo, fundamental para contagiarse emocionalmente (Tylén et al., 2012). Con respecto a la actividad neurofisiológica, Möhring y compañeros (2014) reportan un PRE (N170) asociado con la respuesta en espejo al movimiento de loslabios, con una posible localización en el LPI. Adicionalmente, la supresión del ritmo mu ha sido planteada como uno de los posibles indicadores de actividad en espejo registrada en tareas de imitación (Coll et al, 2014; Iacoboni & Dapretto, 2006).
Se ha propuesto que el SNE es el resultado de un aprendizaje Hebbiano durante los primeros meses postnatales, por lo cual no tendría un origen innato y universal como se ha propuesto. Es probable que el SNE frontal y parietal se organice durante los tres primeros años de vida (Nyström et al., 2011) perfeccionando las habilidades de imitación y sincronía social. Se ha reportado que niños de ocho meses pueden suprimir el ritmo mu durante la observación de movimientos cotidianos (Berchicci et al., 2011; Nyström et al., 2011), mientras que niños de tres años muestran una clara supresión de ondas mu en tareas de intercambio social y observación de acciones sociales (Liao et al., 2015), sin embargo, no es claro si este cambio fisiológico tiene el mismo significado en niños y adultos. En conjunto estas evidencias indicarían que el funcionamiento en espejo de diferentes grupos celulares no es un antecedente sino una consecuencia de los acoples a múltiples niveles que ocurren durante la interacción social sincrónica (Di Paolo & De Jaegher, 2012).
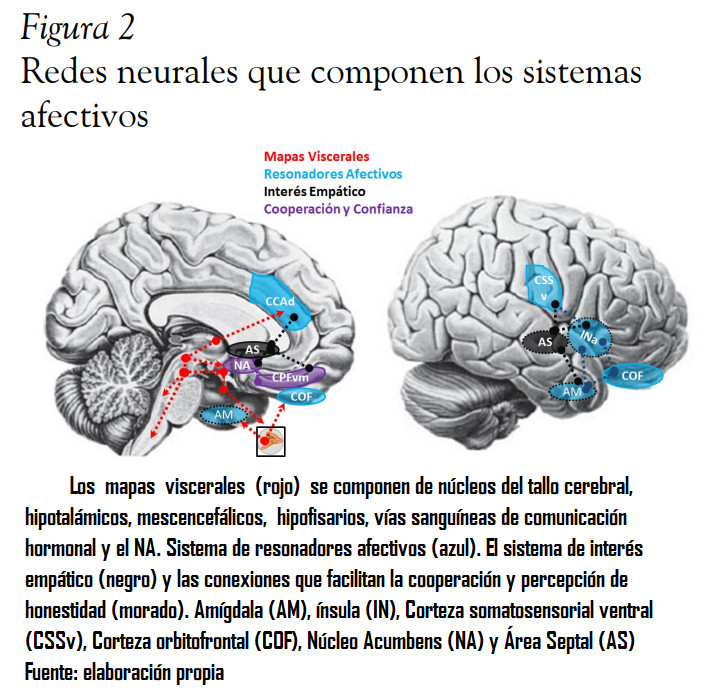
Los sistemas afectivos son un grupo de mecanismos que participan en la asignación de valor biológico a la acción socialmente contextuada (León, 2012), en este modelo se contemplan tres tipos de sistemas afectivos estrechamente relacionados: mapas viscerales, resonadores afectivos y generadores de interés empático.
Son los sistemas afectivos primarios propuestos por Panksepp (1998, 2012), estos sistemas modulan la actividad endocrina y neurovegetativa en forma de mapas viscerales, los cuales se comportan como atractores neurodinámicos, de ellos emergen tanto los aspectos fenoménicos como los comportamentales de las emociones básicas. Panksepp ha propuesto siete sistemas básicos que emergerían en el cerebro-cuerpo mamífero: la búsqueda, el deseo sexual, el juego, el cuidado del otro, la angustia por separación, el temor y la ira, los cuales se constituyen sobre asambleas neurales que reúnen el sistema neurovegetativo y los núcleos del tallo cerebral como el parabranquial, del tracto solitario, el locus ceruleus, la sustancia gris periacueductal, el área tegmental ventral, el hipotálamo y la hipófisis (Para mayor información revisar, Panksepp 1998, 2012)
Este sistema se propone como un conjunto de mecanismos que median el acople entre la discriminación de expresiones emocionales, su corporización y modulación emocional automática. El modelo de simulación ha sido el de mayor acogida para la explicación de la percepción de las emociones (Adolphs, 2002; Heberlein & Adolphs, 2007), en este modelo, la percepción de las emociones está soportada sobre mecanismos similares a los implicados en su experiencia, lo que permite un conocimiento directo de la experiencia ajena, esta hipótesis es apoyada por estudios de registro intracraneal, neuroimagen y lesión (Heberlein & Atkinson, 2009). Por ejemplo, Neal y Chartrand (2011) observaron que las personas con reducción en la actividad muscular facial por lesión, tratamiento con Botox o por bloqueo transitorio, tenían una menor precisión en el reconocimiento de emociones.
El reconocimiento de emociones se desarrolla principalmente en la infancia y niñez, no obstante, la precisión en la decodificación de las emociones continúa cambiando durante la pubertad en formas dependientes del género (Lawrance et al., 2015). Durante los primeros meses de vida parece existir patrones estereotipados de expresión que coinciden con las categorías emocionales adultas (Cole & Moore, 2014), pero no es claro si estos patrones de expresión se acompañan de los cambios fisiológicos y fenoménicos que caracterizan las emociones adultas. Es probable que antes del primer semestre de vida la discriminación de expresiones faciales no sea precisa y no logre generar respuestas psicológicas distintivas (Voos et al., 2012). Evidencias comportamentales y electrofisiológicas señalan que alrededor de los siete meses los infantes comienzan a discriminar de forma consistente expresiones faciales de ira, temor y alegría (Izard et al., 2010), sin embargo, no hay evidencias si esta discriminación se mantiene para estímulos auditivos (Grossmann & Johnson, 2007), al parecer, tanto en adultos como en infantes la discriminación auditiva es bastante limitada y solo permite distinguir entrevalencias positivas y negativas (Adolphs, 2002; Heberlein & Adolphs, 2007).
Dentro de las áreas que más se han vinculado con la percepción de emociones y que servirían como resonadores afectivos se enlistan: corteza occipitotemporal inferior, colículos, amígdala, corteza orbitofrontal (COF), ganglios basales, ínsula, corteza cingulada anterior y corteza parietal derecha (Adolph, 2002; Heberlein & Adolphs, 2007; Heberlein & Atkinson, 2009; Fusar-Poli et al., 2009). La Amígdala parece participar activamente en la discriminación de señales de amenaza, en especial rostros que expresan temor e ira, no obstante, su respuesta ante otras expresiones faciales aversivas como desagrado y tristeza aún es controversial (Adolph, 2008; Tamieto & Gelder, 2010). Los núcleos amigdalinos parecen estar más involucrados en el aprendizaje y codificación de la intensidad de los estímulos con alta prominencia que en la asignación de un valor afectivo específico (Heberlein & Adolphs, 2007; Bonet et al., 2015). Gelder (2006) propone dos rutas que activan la amígdala, una subcortical que parte de los colículos superiores y el núcleo pulvinar, y una cortical que proviene desde la corteza occipital, la primera participa en una detección automática de la prominencia de los estímulos, mientras que la segunda participa en un reconocimiento más lento y explícito (Gelder, 2006). La corteza insular se ha asociado con la percepción de señales viscerales e interoceptivas que sirven como retroalimentación sobre la homeostasis corporal durante las interacciones. En humanos, estudios electrofisiológicos y de neuroimagen han asociado la porción anterior insular con la percepción de sabores y olores desagradables y la porción posterior con el procesamiento de estímulos agradables (Wicker et al., 2003). Además, de la participación de la ínsula en la experiencia y reconocimiento del asco, se ha reportado que los ganglios basales y algunos núcleos amigdalinos participarían en el reconocimiento de señales desagradables condicionadas (Heberlein & Adolphs, 2007). Estudios de lesión, neuroimagen y estimulación magnética transcraneal han coincidido en que la corteza somatosensorial derecha (CSS) participa en la percepción de emociones, las evidencias son más fuertes para emociones como temor y asco y menos consistentes para emociones positivas (Heberlein & Atkinson, 2009), de acuerdo con Adolphs (2002) la CSS genera una imagen corporal de la emoción percibida. La corteza orbitofrontal (COF) derecha se ha asociado con el procesamiento de caras de ira más que de alegría o tristeza, daños en la COF derecha pueden conllevar a una alteración en la percepción emocional facial y auditiva, pero, parece que la COF tiene una actividad mayor cuando la tarea requiere un procesamiento explícito (Adolphs, 2002).
La empatía es una capacidad compleja que se ha ido construyendo a través de la historia evolutiva y cultural de la humanidad (Nelson, 2013), en ella convergen mecanismos afectivos, tendencias sociales, formas de pensamiento y esquemas culturales (Decety, 2007, 2015). De acuerdo con Decety y Cowell (2014), existen al menos cinco procesos que contribuyen a las respuestas empáticas: 1) contagio emocional; 2) autoconsciencia; 3) motivación empática; 4) toma de perspectiva ajena; y 5) procesos regulatorios. En este apartado se hará un énfasis sobre el contagio emocional y el interés empático; la autoconsciencia y toma de perspectiva se amplían en la categoría de atribución mental y los procesos regulatorios se abordan junto con losm sistemas ejecutivos.
La mayoría de estudios de neuroimagen funcional de la empatía se han centrado sobre el contagio emocional durante situaciones de observación y experiencia emocional, por ejemplo: cuando las personas observan vídeos de otros que son tocados o reciben estímulos táctiles activan de forma similar la CSS secundaria (Keysers et al., 2004); observar y experimentar dolor consistentemente activa la CCA (Engen & Singer, 2013; Singer et al., 2004 y 2006); y la percepción o empatía de estímulos que causan asco conllevan a una actividad mayor de la ínsula anterior (Jabbi, Swart & Keysers, 2007). Resultados similares se han observado en animales no humanos y en bebés de pocas semanas de nacimiento (Bischof, 1991), lo cual ha llevado a plantear que el contagio emocional debe tener un desarrollo temprano ontogenética y filogenéticamente (Hatfield & Rapson, 2000).
La motivación empática se refiere a la urgencia e interés por mantener el bienestar de los demás (Decety & Cowell, 2014; Morelli et al., 2012), para Lieberman (2013) este es el aspecto central de la empatía y uno de los principales en la naturaleza social humana. El componente neural central para la motivación empática es el área septal (figura 2), la cual recibe importantes aferencias desde los sistemas de recompensas, cuidado de otros, angustia a la separación, resonancia afectiva y la CPFdm, en su conjunto conforman un sistema que “permite que la respuesta afectiva sea convertida en motivación para ayudar a los demás” (Lieberman, 2013, p. 160), lo que es relevante para promover las conductas prosociales y de cuidado materno (Fleischer & Slotnick, 1978; Moll et al., 2010). Cuando algunas personas interactúan bajo la tendencia apremiante de protegerse mutuamente emerge la cooperación, como un atributo de los sistemas sociales complejos, esto pudo ser decisivo en la supervivencia y desenvolvimiento evolutivo de las especies sociales y es un fundamento esencial para la moralidad humana (Tomasello & Vaish, 2013).
Con respecto a la cooperación, se ha documentado que las personas suelen ser más cooperativas y altruistas si se perciben como siendo observadas (efecto de audiencia), este efecto también ha sido reportado en chimpancés (Jaeggi et al., 2010), ratas (Segura & Gutierrez, 2006) y peces (Bshary & Grutter, 2006). Este tipo de experimentos, muestra un alto nivel de automaticidad en la cooperación sin requerir un mecanismo racional (Jaeggi et al., 2010). Se ha visto que el sistema de recompensa dopaminérgico se activa intensamente cuando hay cooperación recíproca (Rilling y cols., 2004) y cuando se evalúan como confiables los comportamientos ajenos (Tabibnia et al., 2008), incluso, la sola presentación de un compañero cooperativo conlleva a la activación de este sistema (Frith & Frith, 2012), lo cual ha llevado a plantear la cooperación y la ayuda a otros como un elemento altamente reforzante (Lieberman, 2013).
La atribución de honestidad es uno de los elementos más relevantes en la modulación de las respuestas empáticas (Singer et al., 2006), la cooperación y el altruismo (Tabibnia & Lieberman, 2007). Hay evidencias que el sistema de recompensas tiene mayor actividad cuando se perciben actos honestos (Tabibnia, Satpute & Lieberman, 2008), mientras que circuitos del dolor y asco se activan con mayor frecuencia cuando las conductas son consideradas deshonestas o injustas (Sanfey et al., 2003; Wu et al 2015) (figura 2). Se ha reportado que el nivel social modifica la honestidad percibida, de tal forma que individuos con un mayor estatus social muestran una mayor sensibilidad hacia las conductas injusta que los de bajo estatus (Hu et al., 2014), lo cual ha sido corroborado en otras especies con jerarquías sociales (Brosnan & de Waal, 2003).
Además del refuerzo de la conexión social, la desconcexión conlleva a una sensación muy desagradables. Se ha reportado que las tareas que generan exclusión activan significativamente la CCA y los sistemas neuroendocrinos del estrés (Eisenberger & Lieberman, 2004; Eisenberger, Gable, & Lieberman, 2007). En su conjunto, las experiencias positivas y las negativas mantendrían una constante disposición para favorecer el bienestar y evitar el dolor de aquellos que son percibidos como similares. No obstante, pueden existir variaciones individuales vinculadas con polimorfismos genéticos en receptores de dopamina, opioides y oxitocina que modulan la capacidad de resonancia afectiva (Mascaro et al., 2013; Wu et al., 2012).
Este sistema comprende una red neural distribuida cuya principal función es generar una imagen de sí mismo como un agente diferenciado de otros. Ser un agente social incorpora una sensación de dominio sobre las acciones que se ejecutan (agencia) (Tsakiris et al., 2007), en 1983 Libet proporcionó evidencias que las acciones voluntarias son precedidas por un potencial de preparación, este potencial proviene de la actividad de neuronas de las áreas pre-suplementaria (PreSMA) y premotora (CPM) (Haggard, 2008) (Figura 3). La sensaciónde control voluntario sería generada por la comunicación reverberante entre áreas laterales como la PreSMA, CPM y el surco intraprarietal (SIP), mientras que la sensación de propiedad corporal emergería de la interacción entre zonas mediales como la corteza prefrontal medial (CPFm), la corteza cingulada posterior (CCP) y el precuneus. Alteraciones en estas redes podrían estar implicadas en los casos de miembro fantasma donde hay hiperempatía al dolor, tacto y movimiento ajeno (Ramachandran, 2011) y de sinestesia “mirror-touch” donde las personas sienten el tacto de otros (Maister, 2013).
Con respeto al autor-reconocimiento, cerca de terminar el segundo año de vida los niños ya pueden autorreconocerse ante el espejo (Gallup, 1970; Povinelli et al., 1996). En animales nohumano se ha comprobado que muchos de los grandes primates, elefantes (Plotnik et al., 2006) e incluso delfines (DeGrazia, 2009; Reiss & Marino, 2001) han logrado identificar su reflejo en el espejo. Investigaciones con iRMF han encontrado que verse en una fotografía incrementa la actividad en regiones como la CCP, el precuneus y la CCA (Devue et al., 2007; Platek & Thomson, 2007). Puede haber dos procesos implicados con ver la imagen propia: un mecanismo implícito para saber que esa imagen se refiere a uno mismo y uno más explícito de elaboración de creencias acerca de sí mismo.
En los dos primeros años de vida se desarrolla un sistema responsable por la asignación implícita y automática de intenciones a las acciones ajenas. Se ha reportado que niños entre uno y dos años ya tienen un nivel básico de toma de perspectiva visual, ya que reconocen si un agente está mirando un objeto (Moll et al., 2006; Luo & Baillargeon, 2007; Sodian et al., 2007). Al igual, animales no humanos parecen desarrollar niveles básicos de toma de perceptiva (Here et al., 2001), Emery (2009) menciona que animales sociales como delfines, ballenas asesinas, lobos, perros salvajes, caballos, hienas, elefantes, leones, córvidos y loros, demuestran comportamientos sociales complejos que implican toma de perspectiva implícita.
Por ejemplo, hay buenos indicios de que los perros pueden detectar estados atencionales y emocionales de los humanos y guiar así su comportamiento (Call et al., 2002). Niños de 2.5 años y orangutanes pueden formarse imágenes sobre la reputación de otras personas a través de la observación de sus conductas (Hermann y colaboradores, 2013), lo que puede significar un proceso de domesticación en humanos y otros primates (Call & Tomasello, 2008; Emery, 2009). Esta asignación de intenciones se hace como un proceso enactivo y no como uno inferencial (Narvaez, 2012), por ejemplo, en la toma de perspectiva espacial se formaría al emular las acciones ajenas (Kessler & Thomson, 2010).
Con respecto a las redes neurales, trabajos con neuroimágenes y electrofisiología han encontrado que la actividad del STSp y unión temporoparietal (UTP) está asociada con la asignación automática de intenciones (Figura 3) (Frith & Frith, 2012). Por ejemplo, Decety y Cacioppo (2012) observaron una actividad temprana (170 ms) del STSp y la UTP en situaciones de daño intencional, además, se ha reportado una actividad eléctrica temprana (200) en amígdala en condiciones de daño intencional (Hesse et al., 2016). Algunas variaciones en la asignación de intenciones podrían estar relacionadas con polimorfismos del gen del transportador de serotonina (Marsh y colaboradores, 2011a) y receptor de oxitocina (Kumsta & Heinrichs, 2013; Walter et al., 2012), lo cual se ha asociado con fallas en el pensamiento moral en personas con rasgos de psicopatía (Marsh et al., 2011b).
Este sistema se refiere a la capacidad de reconocer que las acciones pueden deberse a las intenciones que las antecedieron. En humanos, la característica principal es el uso de palabras intencionales (desear, querer, sentir, etc.) que aparecen entre el tercer y cuarto año de vida, el uso de estos conceptos pude ser el resultado de la adopción implícita de convenciones sociales y no el reflejo de representaciones conceptuales sobre el mundo social. Entre el tercer y quinto año hay un importante desarrollo del lenguaje sobre emociones y estados mentales, lo que implica al menos tres cambios: 1) incorporación de conceptos mentales, incluyendo sus significados y usos; 2) apropiación de roles y participación en escenarios sociales prototípicos; y 3) reclutamiento de regiones corticales y subcorticales que facilitan la aplicación del conocimiento léxico, semántico y social en la participación en interacciones cotidianas. Las redes que compondrían este sistema son el área parahipocampal, giro temporal superior y corteza prefrontal medial (CPFm).
Desde su aparición en 1978 (Dennett, 1978; Premack & Woodruff, 1978) el concepto de teoría de la mente (TdM) ha recibido una importante atención en psicología y neurociencia cognitiva, la TdM se refiere a la capacidad de ciertos animales de inferir, atribuir o comprender estados mentales ajenos (Call & Tomasello, 2008; Benavides & Moreno, 2011), no obstante, hay diferentes formas y niveles de obtener y usar información sobre los estados afectivos, motivacionales y creencias de los demás (Tirapu et al., 2007). Las dos aproximaciones clásicas a la TdM son: la Teoría-Teoría (TT) que se basa en los procesos de inferencia por medio de mecanismos racionales (Carruthers & Smith, 1996; Gopnik & Wellman, 1992); y la Teoría de la Simulación (TS) que propone que el conocimiento sobre la mente ajena se logra a través de la activación de mecanismos similares a los de la mente propia. No obstante, muchos autores prefieren no usar el término TdM dado su fuerte sesgo hacia la postura TT, en su lugar prefieren usar conceptos como el de mentalización (Frith & Frith, 2013), éste se refiere a los procesos por medio de los que un individuo, de forma implícita y explícita, atribuye estados intencionales (deseos, necesidades, sentimientos, creencias y razones) a sí mismo y a otros (Choi-Kain y Gunderson, 2008; Fonagy y cols., 2002; Frith y Frith, 2012). Las diferentes formas de mentalización reportadas pueden ser agrupadas en tres niveles que se integran en un orden jerárquico: inferencia perceptual, inferencia intencional e inferencia mental (Emery & Clayton, 2009; León, 2013), los cuales se esquematizan en la figura 4, en la cual se muestran los tres niveles inferenciales, cinco mecanismos de mentalización con las edades aproximadas de adquisición y las posibles habilidades que dependen de estos mecanismos.
El nivel de inferencia perceptual se refiere al tipo de procesos abordados en los sistemas de percepción-acción, afectivos y de corporización de intenciones; es un conocimiento implícito, práctico y corporal de las consecuencias inmediatas que siguen a las acciones sociales típicas. Las formas más rudimentarias de este nivel solo permiten asociar contingencias con acciones sociales y se alcanza durante el primer año. Luego los niños entre el primer y segundo año logran atribuir objetivos a las acciones propias y ajenas al realizarlas o simularlas
(intención en la acción), no obstante, esta habilidad se reduce a las intenciones que son visibles en las acciones, lo cual puede ser una
condición sine qua non para la aparición de las formas explicitas de mentalización. La inferencia intencional se remite a los procesos abordados en el sistema de intenciones previas, se remite a la capacidad de interpretar la conducta propia y ajena como precedida por intenciones, esto
es lo que Emery y Claton (2009) definen TdM motivacional.

La inferencia mental explícita o mentalización propiamente dicha (TdM informacional en Emery, 2009), alude a la capacidad de comprender y explicar el comportamiento de los otros recurriendo a estados psicológicos, esta toma de perspectiva explícita ha sido extensamente indagada a través de tareas falsa creencia de primer orden (Baron-Cohen, Leslie & Frith, 1985; Leslie & Frith, 1988; Milligan et al., 2007; Wimmer & Perner, 1983), realización y detección del engaño (Engen & Singer 2012), generación de estados mentales en otros, y uso de doble sentido e ironías (Delgado & Benavides, 2010; Tirapu et al., 2007), en todas estas tareas los niños mejoran su desempeño entre los cuatro y siete años (Frith & Frith, 2003). Un grado más complejo de inferencia mental explícita requiere que las personas puedan elaborar juicios basados en procesos metacognitivos, reflexivos, de abstracción y alto uso de memoria de trabajo (Frith y Frith, 2012) y se desarrollaría de forma importante en la niñez intermedia, estos modos de funcionamiento serán abordados en el apartado de sistemas ejecutivos. Alteraciones en el desarrollo de los mecanismos que permiten la mentalización en cada uno de los anteriores niveles pueden comprometer seriamente el funcionamiento social, la comunicación con los demás, y la noción de sí mismo, fallas que suelen incluirse dentro del espectro autista (Baron-Cohen, Leslie & Frith, 1985; Oberman y Ramachandran, 2007).
De acuerdo con Lieberman (2010 y 2013), durante la realización de tareas de atribución mental se suele hallar una mayor actividad de la CPFdm, los polos temprorales (PT), la UTP, el precuneus y la CCP, de forma similar estas estructuras coinciden con la red por defecto (DMN), esta similitud ha llevado a pensar que la DMN es un sistema que funciona como una memoria de trabajo social, que se desarrolla en la infancia temprana y permite pensar deliberadamente en los otros (Lieberman, 2012a). La forma como participan estas áreas en las diferentes situaciones de mentalización es compleja y suele reflejar dinámicas temporales que conllevan a la heterogeneidad en los estudios de imágenes y actividad eléctrica sobre la TdM (Frith, 2012; León, 2013). Para Lieberman (2010) la actividad de la CPFdm sería el principal marcador de la TdM, con una importante participación en la formación de reglas que permiten comprender cómo la mayoría experimentan y responden a diferentes situaciones. Tareas de mentalización que implican figuras animadas reclutan zonas como el PT y el STSp, lo que hace pensar que un circuito compuesto por CPFdm-PTSTSp sería relevante para la mentalización implícita (intenciones en la acción e intenciones previas). Por otro lado, actividades que inducen la mentalización de forma verbal (falsa creencia y meteduras de pata) consistentemente reclutan la UTP, pero no el PT ni el STSp, por ello es posible que la interconexión entre CPFdm-CCP-UTP (figura 4) sea una de las bases de la mentalización explicita básica (Spunt et al., 2015).
El desarrollo de un sistema de mentalización facilita la participación en escenarios e instituciones sociales normativos, lo que a su vez permite la emergencia de un pensamiento moral explícito en el que se debe juzgar la bondad o maldad de un acto, este pensamiento es soportado sobre un red neural distribuida (Young & Dungan, 2012), que incorpora la actividad compleja y dinámica entre el septum, amígdala, STSp, CPFdm, CPFvm, UTP, CCP y precuneus (Decety & Cacioppo, 2012; Greene, & Haidt, 2002; Lierberman, 2010). Fallas en la actividad de esta red puede conllevar a conductas insensibles y deshumanizantes, típicas en trastornos psicopáticos (Dadds et al., 2011; Kerr et al., 2012), conductas antisociales (Shirtcliff et al., 2009; White et al., 2013) y tendencias violentas entre géneros e intergrupales. Esta insensibilidad está asociada con un pensamiento deshumanizante, en el cual hay se reduce la actividad en el sistema de mentalización (CCP/PC, CPFm, LPI, y STS) (Jack et al., 2013). En muchos de estos casos se puede detectar una contradicción entre moralidad y empatía, ya que una fuerte respuesta empática por personas de un grupo puede llevar a respuestas agresivas y lesivas hacia personas de grupos externos (Decety et al., 2014).
El auto-conocimiento y auto-reflexión son habilidades que surgen de la integración entre el sistema de mentalización y el de elaboración de memorias biográficas, existen evidencias que asocian la actividad de la CPFm cuando las personas realizan juicios acerca de sí mismos (Heatherton, 2011; Lieberman, 2012b), además, esta zona es desproporcionadamente más grande en humanos que en otras especies de primates, lo que significaría un rasgo anatómico y funcional distintivo de la especie humana (Semendeferi et al., 2010) (Figura 4).
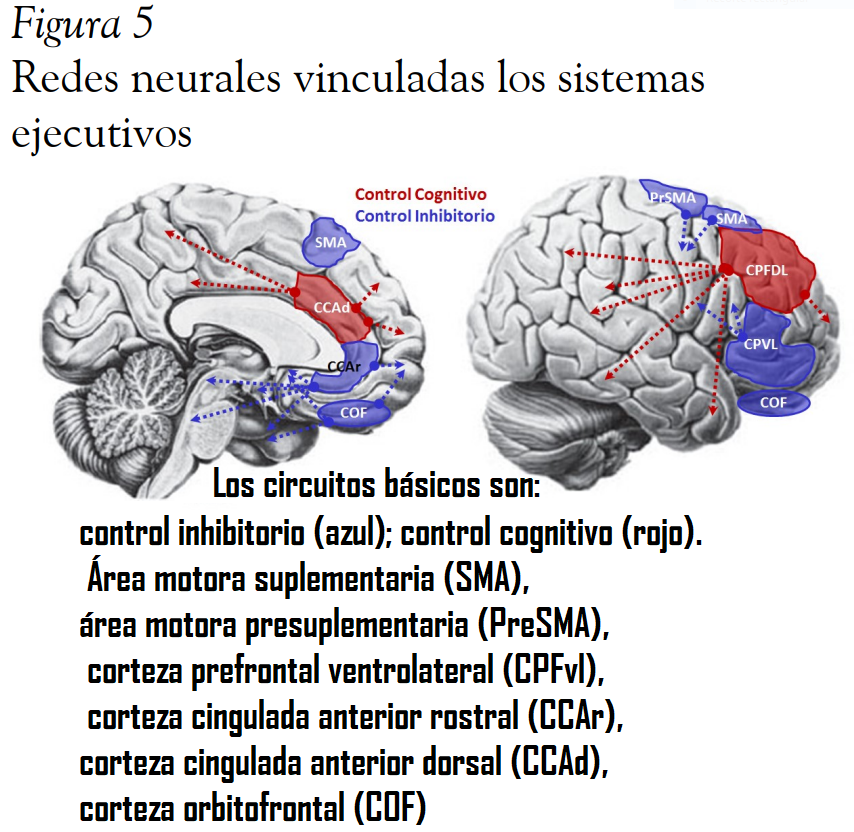
El control voluntario es de los más importantes logros del desarrollo filogenético, ontogenético y cultural humano, este control se establece a partir de la educación socioemocional que tiene lugar durante la niñez y de la integración de las regiones prefrontales en circuitos que permiten una modulación arribaabajo (top-down). Esta dinámica permite generar bucles de retroalimentación entre las demandas ambientales que generan actividad abajo arriba (botom-up) y la supervisión continua por el procesamiento descendente. Existen al menos cuatro formas de control ejecutivo: aplazamiento del refuerzo, inhibición emocional, control del pensamiento y la inhibición de impulsos motores (Lieberman, 2013). En este apartado se describirán brevemente el sistema de control cognitivo y el de control emocional.
Se ha documentado que la CS en los adolescentes y adultos suele estar modulada por procesos descendentes lo cual facilita la participación en instituciones sociales ampliamente complejas (Frith & Frith, 2012), por ejemplo: en el procesamiento de claves sociales contradictorias incrementan la actividad en la corteza prefrontal dosolateral (CPFdl) y la CCAr (Zaki et al., 2010); durante la re-evaluación de prejuicios de raza hubo una amplia actividad de la CPFdl, CCAr y CPFvl (Cunninhan et al., 2004); en la racionalización en juegos económicos se observó una significativa actividad de la CPFdl (Kirk et al., 2011); el uso de un razonamiento utilitarista que requiere la solución de conflictos morales suele reclutar la CPFdl y la CCAr (Greene, 2005; Greene et al., 2004; Moll et al., 2008). Además de la función supervisora y de solución de conflictos, este sistema puede ser altamente relevante para los procesos metacognitivos, en los que se realiza una reflexión voluntaria y declarativa del conocimiento social (Frith & Frith, 2012)
Este sistema se encarga de regular los sentimientos y comportamientos socioemocionales, para que se ajusten a las expectativas sociales. Lieberman (2010), propone que intentos explícitos de autocontrol suele activar una red cerebral que incluye la CPF lateral, CCAr, PreSMA y la CPFdm. Donde la CCA funcionaría como un sistema de detección de conflictos que indica la necesidad de autocontrol y su actividad comenzaría sobre los 300 ms (Angelini et al., 2016). Por otro lado, la corteza prefrontal ventrolateral CPFvl bilateral estaría más relacionada con el esfuerzo explícito de regulación emocional (Cohen J. & Cols., 2011; Heatherton, 2011) y su actividad eléctrica sería más tardía (>450 ms) (Angelini et al., 2016). Diferentes investigaciones resaltan el papel de la CPFvl en la regulación emocional y conductual: pacientes con lesiones en la CPFvl tienden a hacer elecciones más arriesgadas en tareas de riesgo-recompensa (Bechara et al., 1994; Bechara, 2004); la CPFvl derecha está más relacionada con altas ganancias y mayor control de recompensas en juegos de cartas (Cohen et al., 2011); adultos con una mayor actividad en la CPFvl muestran menos signos de angustia ante situaciones de exclusión y rechazo social (Eisenberger & Lieberman, 2004; Eisenberger, Gable, & Lieberman, 2007); por último, en adolescentes maduran primero las regiones de recompensa (estriado ventral y CPFvm) que las de inhibición CPFvl y la CCAr, lo que conlleva a un incremento de las conductas de riesgo (van Leijenhorst & Crone, 2009; van Leijenhorst et al., 2010), efecto que se ve facilitado por la presencia de pares (Blakemore & Robbins, 2012) y la historia de rechazo social crónico durante la niñez (Peake et al., 2013).
A través del artículo se ha intentado proponer un modelo neurodinámico que permita integrar evidencias desde las neurociencias y la psicología del desarrollo de la cognición social. En este modelo las diferentes formas de CS emergerían a partir de la interacción compleja entre sistemas neurobiológicos y sistemas socioculturales, los cuales continuamente se retroalimentan y autoorganizan reflejando una causalidad circular. Esta dinámica podría rastrearse en escalas temporales como la filogénesis, la evolución cultural, la ontogénesis (figura 4) y situaciones cotidianas (figura 6).
A continuación se hace una rápida exploración de la neurodinámica que ocurriría durante las situaciones sociales (figura 6): en ventanas temporales tempanas (5 a 20ms) (Wang et al., 2010) ocurre la construcción de imágenes sensoriales subcorticales a partir de la actividad de estructuras como los colículos superiores, inferiores y el bulbo olfatorio (Damasio, 2010), las cuales facilitan la discriminación automática de valores biológicos vitales (León, 2012); de las aferencias sensoriales subcorticales se generan imágenes afectivas primarias por parte de núcleos del tallo y límbicos que mapean y controlan la actividad visceral (figura 2), la respuesta eléctrica de estas zonas puede ocurrir entre los 30 a 150 ms; 3) paralelamente a la generación de los mapas afectivos primaros se crean mapas perceptuales sociales (figura 1), los que podrían estar asociados a potenciales evocados que suceden 170 ms iniciado el estímulo social (Ibañez et al., 2012); 4) las imágenes sociales y afectivas primarias inducen la actividad de circuitos afectivos secundarios (figura 2 y 3), los cuales amplifican la respuesta afectiva primaria y facilitan la asociación entre señales perceptuales sociales y estados fisiológicos (Tamieto & Gelder, 2010), la respuesta de estas zonas se daría entre 150 y 250ms (Adolphs, 2002, Pessoa & Adolphs, 2010) y podría estar asociada con el contagio emocional, las motivaciones empáticas y la asignación de intenciones implícita de intenciones; 5) paralelamente a la actividad de los resonadores afectivos ocurre la de los resonadores sensoriomotores, conformando un bucle de percepción-acción que facilita la resonancia y retroalimentación entre los participantes de la interacción social (figura 1), se han reportado potenciales ERN 7 (80-100ms) y FRN 8 (250-300ms) en la CCA ante situaciones desagradables (Lavin et al., 2013) y actividad eléctrica a los 170ms en el LPI en tareas de imitación (Möhring et al., 2014); 6) una vez se cuentan con imágenes sociales y afectivas ocurre la generación de conocimiento social, en este nivel se dan procesos de categorización explicita en el marco de teorías mentales más consistentes (Zhen et al., 2013), en las cuales participan las redes involucradas en la mentalización y el autoconocimiento, la actividad de estas redes se daría en una tiempo cercano a los 400ms; 7) por ultimo tendríamos la actividad de los sistemas de control ejecutivo, responsables de la reevaluación de las imágenes afectivas y sociales creadas de forma más temprana, este control descendente se entre los 300 y 600 (Ibañez et al., 2013; Kirk et al., 2011).
La cognición social se ha convertido en uno de los temas de mayor interés dentro de la psicología cognitiva, las ciencias sociales y la neurobiología, no obstante, los modelos basados en posturas del procesamiento de información presentan diferentes dificultades conceptuales y epistemológicas. Las posturas de la cognición enactiva y de los sistemas dinámicos se han mostrado como una opción válida para integrar la diversidad de evidencias sobre el comportamiento social, en este sentido, el artículo intenta proporcionar un marco epistemológico que comprende el carácter sistémico, cambiante, auto-organizado, complejo, corporizado y situado del pensamiento social.
El modelo propuesto en este artículo es un paso para la construcción de una aproximación integrativa y ecológica con la cual sería posible refinar conceptual y metodológicamente la investigación sobre el comportamiento social. En un futuro próximo la neurociencia y psicología social tendrán que recurrir a diseños metodológicos en segunda persona (Schilbach et al., 2013), ya que al parecer hay profundas diferencias neurobiológicas entre observar y participar en escenarios sociales (Tylen et al., 2012), lo cual ha llevado a un serio cuestionamiento de los estudios en neurociencia cognitiva clásica, ya que gran parte de sus resultados se desprende de situaciones experimentales individuales en la que no hay genuina interacción social (Liu & Peloswi, 2014). Una alternativa son los estudios de hiperescanéo, en los que es posible registrar en tiempo real la actividad eléctrica y metabólica encefálica de dos o más individuos que interactúan (Dumas et al., 2011), donde la actividad de los diferentes sistemas nerviosos parece acoplarse en un único sistema denominado hipercerebro (Koike et al., 2015), de tal forma que los eventos de la cognición social implicarían múltiples escalas espaciotemporales que exceden el análisis de los sistemas intraindividuales y que requerirán el empleo de modelos matemáticos que permitan analizar el comportamiento complejo y dinámico (Richardson et al., 2014).
Enlace al texto original: http://www.scielo.org.co/pdf/rups/v15nspe5/v15nspe5a10.pdf